A remoção de nitrato (NO3–) presente na água utilizada para consumo humano além de necessária, é regulamentada pela portaria n° 888 do Ministério da Saúde, indicando que a concentração da substância deve ser mantida abaixo de 10 mg/L (em base N) de modo a evitar danos à saúde.
Comumente se encontram fontes de água subterrânea com teores de NO3– acima do permitido, e quando isto ocorre, a troca iônica é sempre uma das alternativas consideradas como rota tecnológica para a remoção de nitrato. Para esta aplicação, as resinas aniônicas são aplicadas no ciclo Cl–, e após sua exaustão, são regeneradas com soluções de NaCl. As reações de troca iônica e regeneração são apresentadas abaixo. R representa a resina e seu grupo funcional sem fazer distinção quanto ao tipo de grupo funcional.
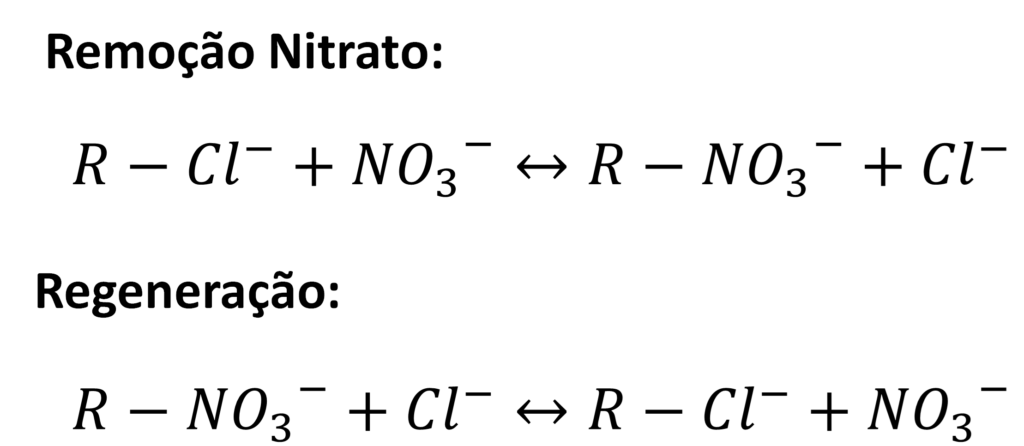
Dois tipos de resinas podem ser utilizados para remoção de nitrato, sendo elas as Aniônicas Fortemente Básicas de tipo I (SBA Tipo I) e as resinas seletivas, sendo estas referidas como resinas com melhor desempenho e eficiência na remoção da substância. Em geral, a escolha entre esses dois tipos de resinas é feita levando em consideração a química da água, em especial a presença de sulfato (SO42-).
Os fatores de separação das resinas SBA tipo I para os ânions Cl–, NO3– e SO42- são apresentados na Tabela 1 (estes são valores médios e encontrados na literatura; os valores podem variar de acordo com o fabricante da resina e com a química da água). O fator de separação pode ser interpretado como a preferência da resina pelos diferentes ânions, tomando como base determinada forma iônica. Quanto maior o fator de separação, maior será a facilidade e o uso da capacidade da resina para remover o ânion de interesse.
Tabela 1 – Fatores de separação para Cl–, NO3– e SO42- para uma resina SBA tipo I.
| Ânion | Fator de separação (αAB) |
| Cl– | 1,0 |
| NO3– | 3,2 |
| SO42- | 9,1 |
A análise dos fatores de separação demonstra uma preferência de cerca de 2,84 vezes para uma resina SBA tipo I na troca do íon NO3– pelo SO42-. Desta forma, percebe-se que a concentração de SO42- na água é o principal fator limitante na escolha da resina ideal para remoção de nitrato.
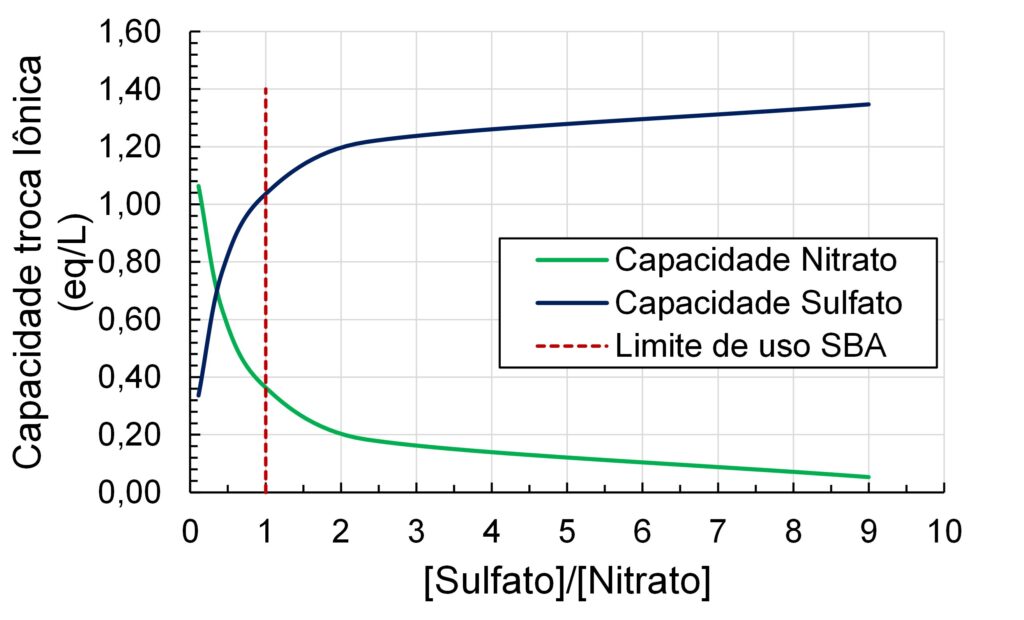
Utilizando os valores do fator de separação apresentados e considerando uma resina SBA tipo I com uma capacidade total de troca iônica de 1,4 eq/L, podemos calcular a capacidade de troca para cada ânion em função da razão de concentrações do sulfato e nitrato presente na água. Os cálculos em forma gráfica são apresentados na Figura 1. Para estes cálculos assumiu-se concentração total na água sempre igual a 3 meq/L e que se atingisse o equilíbrio termodinâmico entre a resina e a água.
Figura 1 – Relação entre a capacidade de troca iônica para os íons NO3– e SO42- em função da razão [Sulfato]/[Nitrato] para uma resina SBA tipo I.
Fonte:
Os autores.
À medida que a concentração de sulfato aumenta, a capacidade disponível na resina para remoção de nitrato cai. O valor-limite encontrado frequentemente na literatura para uso de uma resina SBA tipo I para remoção de nitrato é para a razão [Sulfato/Nitrato] = 1 (demarcada pela linha vertical vermelha). Razões acima do valor-limite prejudicam a operação do equipamento e aumentam os custos de OPEX. Desta forma, para águas onde [Sulfato/Nitrato] ≥ 1, é recomendado a aplicação de uma resina seletiva para NO3–.
Mas afinal, o que uma resina seletiva para remoção de nitrato possui de diferente?
A diferença entre esses dois tipos de resina costuma ser um ponto de dúvida comum, muito pelo fato de que se analisarmos as fichas técnicas para modelos de resina SBA tipo I e resinas seletivas para NO3– as propriedades relatadas são muito similares, e o grupo funcional (fator que faz com que as resinas seletivas sejam seletivas) relatados para ambos os tipos de resina é o quaternário de amônio. Este fato pode causar estranheza em primeira instância por induzir a pensarmos que o grupo funcional de ambas as resinas é o mesmo.
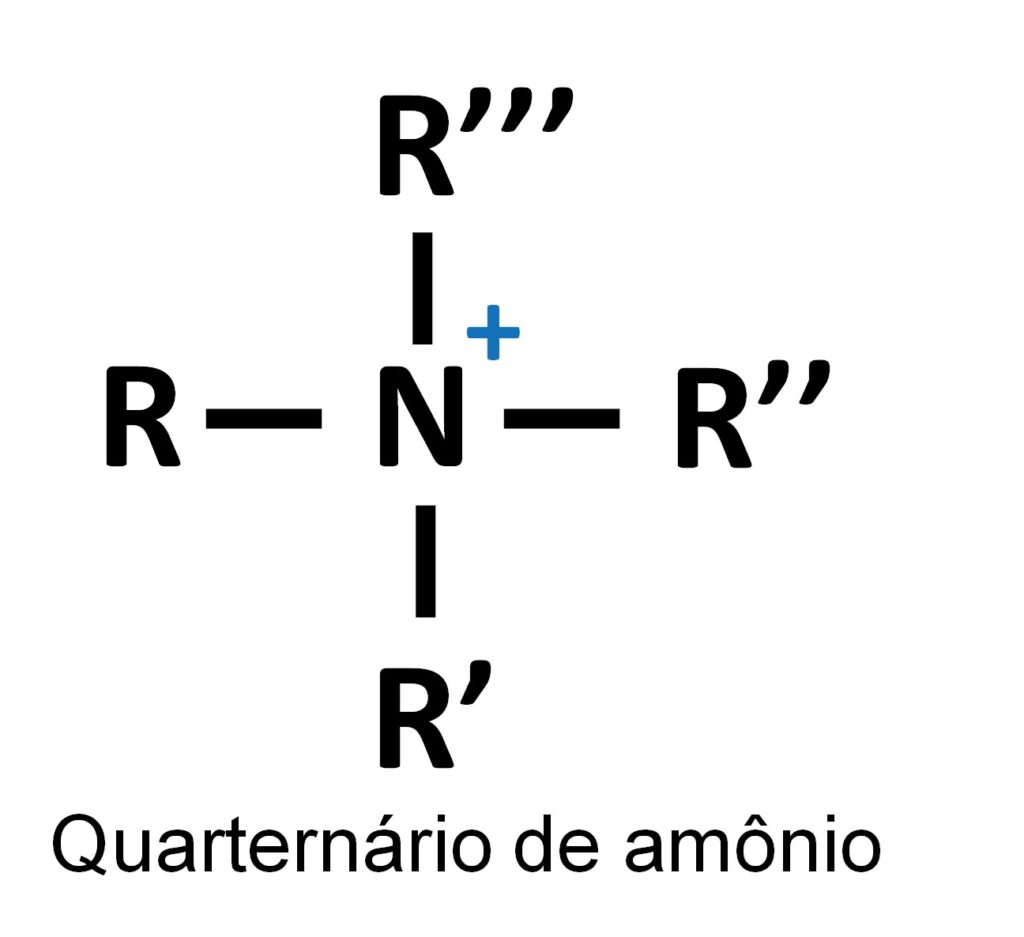
Para entender a diferença entre as resinas, primeiro precisamos compreender o que de fato é um composto quaternário de amônio (Figura 2). Um composto denominado de quaternário de amônio corresponde a uma amina com quatro ligações covalentes com grupos de carbono, os quais podem ser alifáticos ou aromáticos. A quarta ligação covalente (chamada de ligação covalente dativa, até alguns anos atrás) é feita apenas com o par de elétrons livre do nitrogênio (N), e este fator faz com que o N adquira uma carga positiva, tornando-o as espécies quaternárias de amônio um ótimo grupo funcional para troca de ânions.
Figura 2 – Representação genérica de um composto quaternário de amônio.
Fonte: Os autores.
Na Figura 2, os grupos R, R’, R’’ e R’’’ correspondem aos substituintes alifáticos ou aromáticos e podem ser iguais ou diferentes entre si. São estes substituintes que diferem as resinas SBA tipo I das resinas seletivas. Como exemplo, iremos considerar as resinas Trilite SAR10 (SBA tipo I) e a resina Trilite CLR-N (seletiva) para verificar a diferença entre os grupos funcionais.
A Figura 3 apresenta uma representação molecular 3D para o grupo funcional de ambas as resinas (Cinza: C, Azul: N, Branco: H). Os substituintes R para a resina SAR10 são grupos metil, com um carbono, enquanto para resina seletiva os substituintes são grupos etil, com dois carbonos.
Figura 3 – Grupos funcionais para as resinas Trilite SAR10 (SBA tipo I) e Trilite CLR-N (seletiva).

Fonte: Os autores.
A diferença entre a seletividade e preferência para os dois tipos de resina reside nas diferenças do grupo funcional, porém a gênesis da diferença de seletividade não é devido a basicidade do grupo funcional, mas sim por questões estéricas. Para que a reação de troca iônica ocorra é necessário que o ânion a ser removido (sulfato ou nitrato) chegue até o sítio ativo, e um fator determinante para isto é o diâmetro dos íons. O raio iônico e o raio hidratado para diferentes ânions são apresentados na Tabela 2.
Tabela 2 – Raio iônico e raio hidratado para alguns ânions em solução aquosa.
| Ânion | Raio iônico (nm) | Raio hidratado (nm) |
| F– | 0,124 | 0,263 |
| Cl– | 0,180 | 0,319 |
| NO3– | 0,177 | 0,316 |
| SO42- | 0,242 | 0,382 |
Fonte: Marcus, Y. Ionic Radius in aqueous Solutions. Chem. Rev. 88, 1475-1498 (1988).
Como observado na Tabela 2, o raio hidratado do SO42- é maior comparado com o raio hidratado do NO3–, sendo este fator responsável por dificultar o acesso do SO42- ao sítio ativo dos grupos funcionais de uma resina seletiva. Ao observarmos a Figura 3, os átomos de C e H dos substituintes etil fazem com que o átomo de N carregado positivamente seja espacialmente mais impedido que o átomo de N rodeado por grupos metil. Este fenômeno recebe o nome de impedimento estérico, sendo o responsável pela diferença de seletividade entre os tipos de resina e fator que favorece o uso das resinas seletivas em condições em que [Sulfato/Nitrato] ≥ 1.
A Liter possui a expertise necessária em tratamento de água para auxiliar você a optar pela resina ideal para a remoção de nitrato. Entre em contato com nossos especialistas e entenda como podemos ajudar os seus processos a serem ainda melhores!
Leia também: Desmineralização da água com resinas de troca iônica.