O interesse das agências reguladoras na desinfecção da água vem aumentando ao longo das últimas décadas através do estabelecimento de regras mais rígidas no controle de microrganismos. (Cheremisinoff, 2002)
O Cloro é a substância mais comum utilizada para desinfecção da água e a adição desta substância é conhecida como cloração. (Spellman, 2013)
Entretanto o cloro pode ser danoso a alguns processos industriais, ou mesmo indesejável para o consumo humano. (American Water Works Association, 2006)
Por este motivo, costuma-se utilizar processos para remoção de Cloro ativo da água, onde o filtro de carvão ativado vem sendo aplicado com grande aceitação. Estes filtros não são dimensionados para remover partículas em suspensão ou bactérias. Na verdade, filtros de carvão favorecem o crescimento bacteriano, pois os mesmos adsorvem matéria orgânica, provendo nutrientes. (Kucera, 2010)
Histórico
Um dos primeiros registros relacionando o uso do Cloro Livre na água com intuito de sanitizá-la data de 1893, e é conhecido como Método de Traube, onde o Químico Moritz Traube descreve um simples, porém eficiente método para manter a água livre de microrganismos. Este método prescrevia a adição de Hipoclorito de Cálcio. Em virtude do cloro ativo contido no composto, este método é capaz de destruir as bactérias presentes na água em poucas horas, mesmo que a sua concentração seja baixa. (Turneaure & Russell, 1901)
A cloração da água, como forma de sanitizá-la, somente passou a ser adotada com maior intensidade após um caso de contaminação por febre tifoide da população da cidade de Lincoln, em 1905. (Reece, 1907)
Na sequência há registros de diversos locais adotando diferentes métodos para o controle microbiológico com cloro ativo, como em Nova Jérsei (Leal, Fuller, & Johnson, 1909) e em Chicago que adotaram em 1908, dois anos depois o cloro livre foi aplicado a fim de controlar o crescimento de microrganismos da água em Nova Iorque, Montreal, Milwaukee, Cleveland, Nashville, Baltimore e Cincinnati. (Hooker, 1913)
Estima-se que já em 1918 mais de mil cidades tratavam cerca de 11.000.000 m³/dia utilizando o cloro livre como forma de evitar o crescimento microbiológico na água. (Race, 1918)
Cloração
De acordo com (Spellman, 2013), atualmente o método de desinfecção da água por cloração tornou-se o mais utilizado na prevenção doenças provenientes de microrganismos que se espalham pelo uso da água.
A eficiência da cloração depende primeiramente de quatro fatores: concentração (C), tempo de contato (T), pH e temperatura. Estes fatores combinados são chamados de CT, ou concentração (em mg/l) multiplicado pelo tempo (em minutos) em um dado pH e temperatura. (American Water Works Association, 2006)
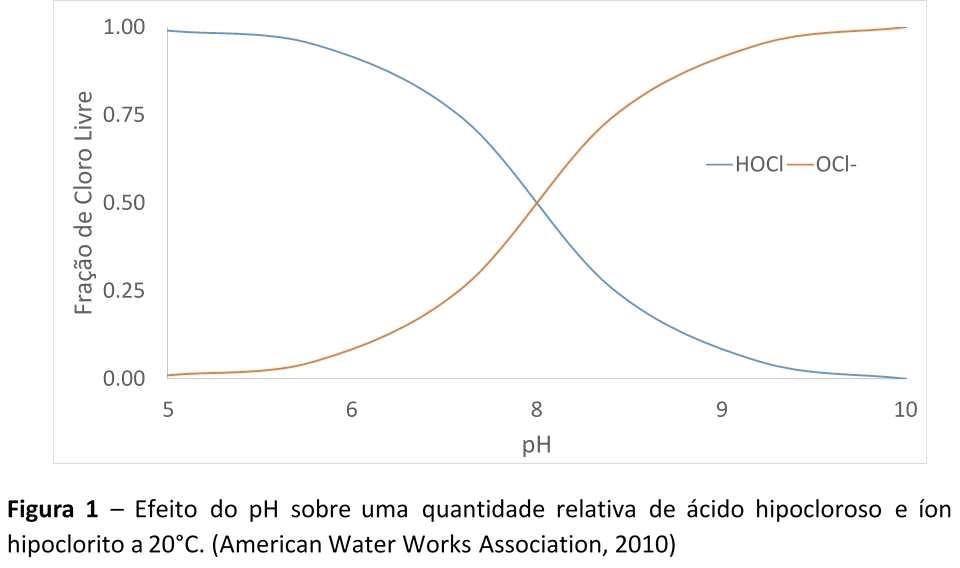
À medida que o pH fica superior a 7,5 (a 20°C), a concentração de Cloro Livre, na forma do íon Hipoclorito (OCl–) se torna maior do que a concentração do Cloro Livre na forma de Ácido Hipocloroso (HOCl), como pode ser observado na Figura 1. (Black & Veatch Corporation, 2009)
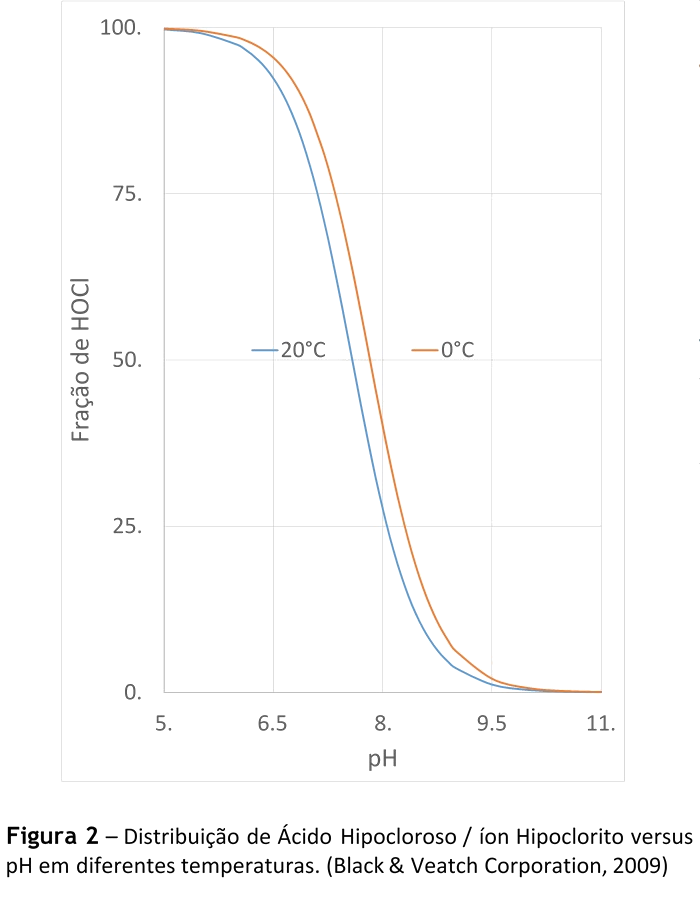
A temperatura também influencia no equilíbrio desta reação, principalmente quando o pH está na faixa de 7 a 8, não sendo ela dependente da concentração de Cloro Livre na água, conforme pode ser observado na Figura 2. (Black & Veatch Corporation, 2009)
A combinação da concentração de HOCl e OCl– é conhecida como Residual de Cloro Livre (RCL). Estas duas espécies reagem de forma distintas, onde o HOCl é um desinfetante e um oxidante muito mais potente do que o OCl–. (Black & Veatch Corporation, 2009) O Ácido Hipocloroso irá desinfectar 100 vezes mais rápido do que o íon Hipoclorito, porém será consumido numa taxa muito mais rápida. (American Water Works Association, 2006)
Decloração
Apesar das diversas vantagens em se manter a água clorada, em alguns momentos será necessário remover este Cloro Livre, seja para remover sabores ou mesmo para proteger algum processo industrial específico.
De acordo com Black & Veatch Corporation, o sabor do Cloro Livre pode ser sentido em concentrações superiores a 0,3 ppm, fazendo com que algumas residências optem por removê-lo ao beber.
Essencialmente a decloração não é necessária para garantir a potabilidade da água, mas o residual de cloro pode ser removido para torná-la mais agradável. (Cheremisinoff, 2002)
Entretanto grande parte das aplicações para remoção de cloro estão na indústria, em processos específicos, como por exemplo sistemas de resfriamento de água onde devem ser evitados os usos contínuos de cloro, pois oxidantes, como o cloro, podem inibir a formação de filmes nas superfícies dos metais, agindo como um decapante, destruindo o filme passivado (NALCO Chemical Company, 2009).
Esta limitação em relação ao cloro livre presente na água não é exclusividade de equipamentos com componentes metálicos, pois de acordo com (Trussell, Crittenden, Hand, Howe, & Tchobanoglous, 2012), resinas de troca iônica, especialmente as de base de poliestireno sulfonado, podem ser suscetíveis à oxidação, tornando-as ineficientes em pouco tempo de uso.
O mesmo ocorre com membranas de Osmose Reversa e Nanofiltração à base de Poliamida, que são sensíveis a presença de cloro livre. A degradação da membrana de poliamida ocorre após algumas horas de uso mediante a presença do Cloro, onde a taxa de degradação vai depender fortemente do pH da água e da presença de metais em transição, como o Ferro, por exemplo. (Kucera, 2010) De forma geral, a degradação pode ocorrer após (aproximadamente) 200 a 1000 horas com exposição de até 1ppm de cloro livre. (Dow Water & Process Solutions)
Para estas, e muitas outras aplicações, se faz necessário um tratamento prévio visando a remoção do cloro livre presente na água.
O carvão ativado pode remover o cloro livre (e outros oxidantes) da água através de uma reação de oxi-redução, onde o carvão é oxidado e o Cloro é reduzido para Cloreto (Kucera, 2010), conforme demonstrado nas equações abaixo:
Cl2 + H2O + C* → 2H+ + 2Cl– + C*O
HOCl + C* → H+ + Cl– + C*O
OCl– + C* → Cl– + C*O
Onde:
C* = Carvão Ativado
C*O = Carvão oxidado
De forma geral, a água que passa por um leito de carvão ativado é considerada totalmente declorada. O estudo que relaciona a ação que ocorre entre o carvão ativado e o cloro livre é detalhada na equação abaixo (Black & Veatch Corporation, 2009):
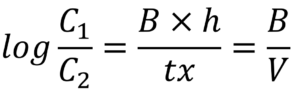
Onde:
C1 = Concentração de Cloro Livre na entrada do filtro (mg/l)
C2 = Concentração de Cloro Livre na saída do filtro (mg/l)
B = Constante de eficiência do carvão ativado
h = Altura do leito de carvão ativado (ft)
tx = Taxa de filtração (gpm/ft²)
V = Taxa de vazão (gpm/ft³)
Se você tem dúvidas em relação a qualidade da sua água, entre em contato com a LITER para que possamos auxiliá-lo a encontrar a melhor solução.
Bibliografia
American Water Works Association. (2006). Water Chlorination/Chloramination Practices and Principles – Manual of Water Supply Practices—M20 (2ª ed.). Denver, Estados Unidos da América: American Water Works Association.
American Water Works Association. (2010). Water Quality and Treatment – A Handbook on Drinking Water (6ª ed.). (J. K. Edzwald, Ed.) Denver, Colorado, Estados Unidos: McGraw-Hill Education.
Black & Veatch Corporation. (2009). White’s Handbook of Chlorination and Alternative Disinfectants (5ª ed.). Hoboken, NJ: John Wiley & Sons, Inc.
Cheremisinoff, N. P. (2002). Handbook of Water and Wastewater Treatment Technologies (1ª ed.). Woburn, MA, Estados Unidos da América: Butterwofih-Heinemann.
Connell, G. (1996). The Chlorination/Chloramination Handbook. Denver: American Water Works Association.
Dow Water & Process Solutions. (n.d.). FILMTEC™ Reverse Osmosis Membranes – Technical Manual (Form No. 609-00071-0309). Retrieved 10 26, 2015, from Dow Water & Process Solutions: http://msdssearch.dow.com/PublishedLiteratureDOWCOM/dh_08db/0901b803808db77d.pdf?filepath=liquidseps/pdfs/noreg/609-00071.pdf&fromPage=GetDoc
Hooker, A. H. (1913). Chloride of Lime in Sanitation (1 ed., Vol. 1). Londres: New York : J. Wiley & Sons. Retrieved Outubro 20, 2015, from https://archive.org/stream/chlorideoflimein00hookrich#page/n3/mode/2up
Hui-Hsin Tsenga, J.-G. S. (2011, Agosto 30). Synthesis of granular activated carbon/zero valent iron composites for simultaneous adsorption/dechlorination of trichloroethylene. Journal of Hazardous Materials, pp. 500-506. Retrieved Outubro 26, 2015, from http://www.sciencedirect.com/science/article/pii/S0304389411006868
Kucera, J. (2010). Reverse Osmosis: Design, Processes, and Applications for Engineers (1ª ed.). Salem, MA, Estados Unidos da América: Wiley-Scrivener; 1 edition.
Leal, J. L., Fuller, G. W., & Johnson, G. A. (1909). The sterilization plant of the Jersey City Water Supply Company at Boonton, N.J. Nova Jérsei: Milwaukee, Wis., Amer. Water Works Assoc.
NALCO Chemical Company. (2009). The Nalco Water Handbook (3ª ed.). (D. J. Flynn, Ed.) Columbus, OH, Estados Unidos da América: McGraw-Hill Education.
Race, J. (1918). Chlorination of water (1ª ed.). Nova Iorque, Nova Iorque, Estados Unidos da América: Wiley & sons, inc.
Reece, R. (1907). Report on the Epidemic of Enteric Fever in the City of Lincoln, 1904-5. Londres: Local Government Board.
Spellman, F. R. (2013). Handbook of Water and Wastewater Treatment Plant Operations (3ª ed.). Boca Raton, Flórida, Estados Unidos da América: CRC Press.
Trussell, R. R., Crittenden, J. C., Hand, D. W., Howe, K. J., & Tchobanoglous, G. (2012). MWH’s Water Treatment – Principles and Design (3ª ed.). Hoboken, NJ, Estados Unidos da América: John Wiley & Sons, Inc.
Turneaure, F., & Russell, H. (1901). Public Water-Supplies: Requirements, Resources, and the Construction of Works (01 ed., Vol. 1). Nova Iorque, Nova Iorque, Estados Unidos da América: John Wiley & Sons. Retrieved Outubro 20, 2015, from https://archive.org/stream/publicwatersuppl00turnrich#page/n5/mode/2up



